手順 硫酸銅水溶液(2ml)にアンモニア水(2ml)を加える 結果 ①の時は水溶液が青色から深青色に変化し、少しだけ白い沈殿ができた。 ②の時は白い沈殿と薄い水色と深青色の三層にQ39 硫酸銅の性質とアンモニア水と硝酸バリウムの関係.(Q36の続き) Q38 固体の無水硫酸銅(白色)に水を加える.(Q36の続き) Q37 ホットプレートを使う理由.(Q36の続き) Q36 計算して出した理論値と実測値がずれる理由. Q34 温度による溶解度差を利用しないで再結晶させる方法. Q32 硫黄と鉄硫酸銅 のアンモニア水溶液に アルコール を加えると Cu (NH 3) 4 SO 4 ・H 2 Oの大きな青紫色結晶が生じる。 この錯体では,4個のアンモニア分子が銅のまわりに平面正方形に配位し,それと垂直な方向に1個の水分子が配位している。

アクセス化学 例題解説 基本例題90 銅イオンの反応
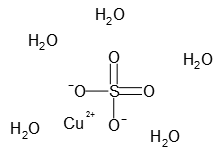
硫酸 銅 アンモニア
硫酸 銅 アンモニア-酸触媒法では、濃硫酸を使うため、中和にアンモニアを使って、副生硫酸アンモニウム を回収する。 酸触媒法の反応式: ch 2 =chcn + h 2 o + h 2 so 4 + 2nh 3 → ch 2 =chconh 2 + (nh 4) 2 so 4 一方、銅触媒法では硫酸を使わないため、副生硫酸アンモニウムが発生し硫酸銅五水和物 CuSO 4 ·5H 2 O を金属銅から合成し、 物質の磁気的な性質に触れる。 合成に先立ってろ過操作、晶析の基本を確認する。 1C1 ろ過操作・結晶分取 01 mol/L ミョウバン(硫酸アルミニウムカリウム KAl (SO 4) 2 ·12H 2 O)溶液 試験管にホウ酸と




硫酸銅が溶ける様子と粒子の運動 State That Copper Sulfate Melts Youtube
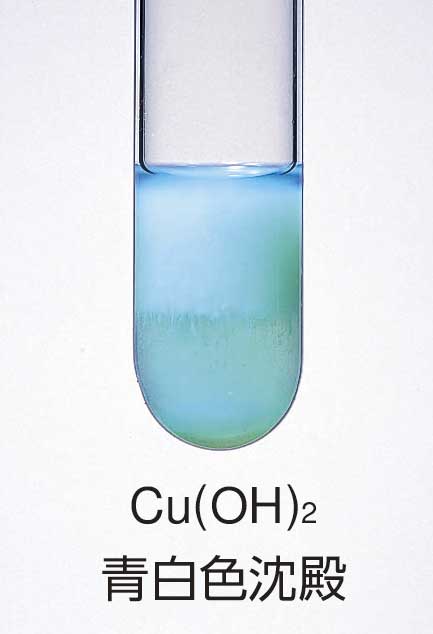
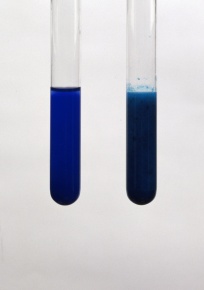
アンモニア水との反応 2Cu 8NH 3 O 2 2H 2 O → 2Cu(NH 3) 4 2 4OH硫酸銅水溶液とアンモニア水との反応 CuSO 4 aq 2NH 3 aq 2H 2 O → Cu(OH) 2 (s)↓ (NH 4) 2 SO 4 aq K sp = 15×10 過剰のアンモニア水との反応 Cu(OH) 2 (s) 4NH 3 aq → Cu(NH 3) 4 2 aq アンモニア過剰でテトラアンミン銅(ii)イオン cu(nh3)42 を生じます。 元の硫酸銅の量にもよるので一概には言えませんが、 ビーカー中の硫酸銅水溶液に薄いアンモニア水を数滴垂らす程度ならば水酸化銅(ii)の沈殿を生じるのみでしょう。少量のアンモニア水 過剰のアンモニア水 硫酸銅(Ⅱ)水溶液 水酸化銅(Ⅱ) テトラアンミン銅(Ⅱ)イオン CuSO4aq Cu(OH)2↓ Cu(NH3)42 青色溶液 青白色沈殿 深青色溶液 記録欄記入例 B(2)青白色の沈殿が生成した。 (3)青白色の沈殿が消え,深青色の溶液が得られた。 実施上の注意点 A ガス
硫酸銅水溶液などの銅 (Ⅱ)イオンに塩基性のアンモニア水を加えると、 Cu 2 2OH - → Cu (OH) 2 ↓ 水酸化銅の青白色沈殿がゲル状になって生成します。 そのまま静置すれば試験管の下の方に溜まってきます。 そこに、さらに過剰のアンモニア水を加えていくと、次第に水酸化銅の沈殿が溶けて、濃青色の透明水溶液となります。 Cu (OH) 2 4NH 3 ⇄ Cu (NH 3) 4 2 2OH青い硫酸銅水溶液にアンモニア水を加えると、水酸化銅ができるが、中性であるので水への溶解度が低く白い沈殿ができます。 これは、アンモニア水のOH が銅イオンに配位したためです。 熱した硫酸銅 (Ⅱ) 水溶液に炭酸ナトリウム水溶液を加えてできる沈殿 CuSO 4 3 Cu (OH) 2 を集め,メチルレッドが黄変するまでアンモニア水に溶かし,水酸化ナトリウム水溶液を加えてつくる。深紫青色。セルロースを溶かす性質がある。実用的には安定剤としてグルコースを加える
硫酸銅にアンモニアを加える時について。 実験で、「硫酸銅(ii)水溶液をかき混ぜながらアンモニア水を1滴ずつ加える」という操作を行いました。 アンモニア水が落ちたところが濃い紫色になって、混ぜているとその紫色がすぐに消えました。 水溶液は準備硫酸銅 (Ⅱ) ,水酸化ナトリウム,硫酸の各1 mol/L 水溶液,濃アンモニア水,蒸留水,ビーカー,ガラス棒,ろうと,ろ紙,注射器等 手順 ① 硫酸銅 (Ⅱ) 水溶液10 ml に,水酸化ナトリウム水溶液 ml を加え,水酸化銅 (Ⅱ) を沈殿させる。 (写真1)珪酸ソーダ 水酸化バリウム 水酸化アルミニウム 三酸化アンチモン アスコルビン酸(ナトリウム) 塩化第二鉄




銅と銅イオンの性質と化合物まとめ 沈殿の色など Irohabook



無機化学 第12回 遷移元素 Cu Ag 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム
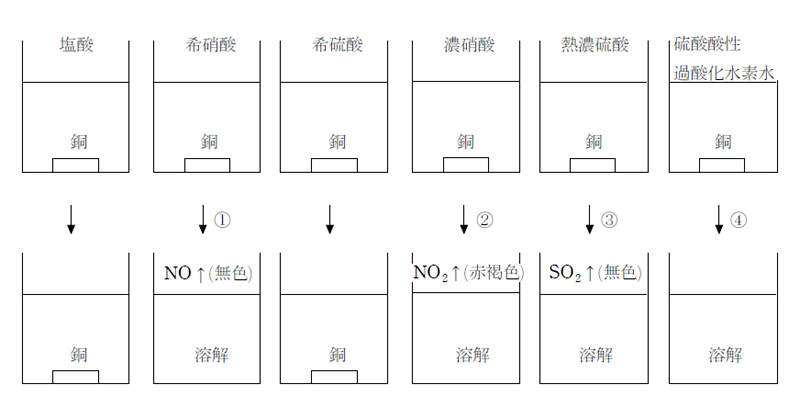
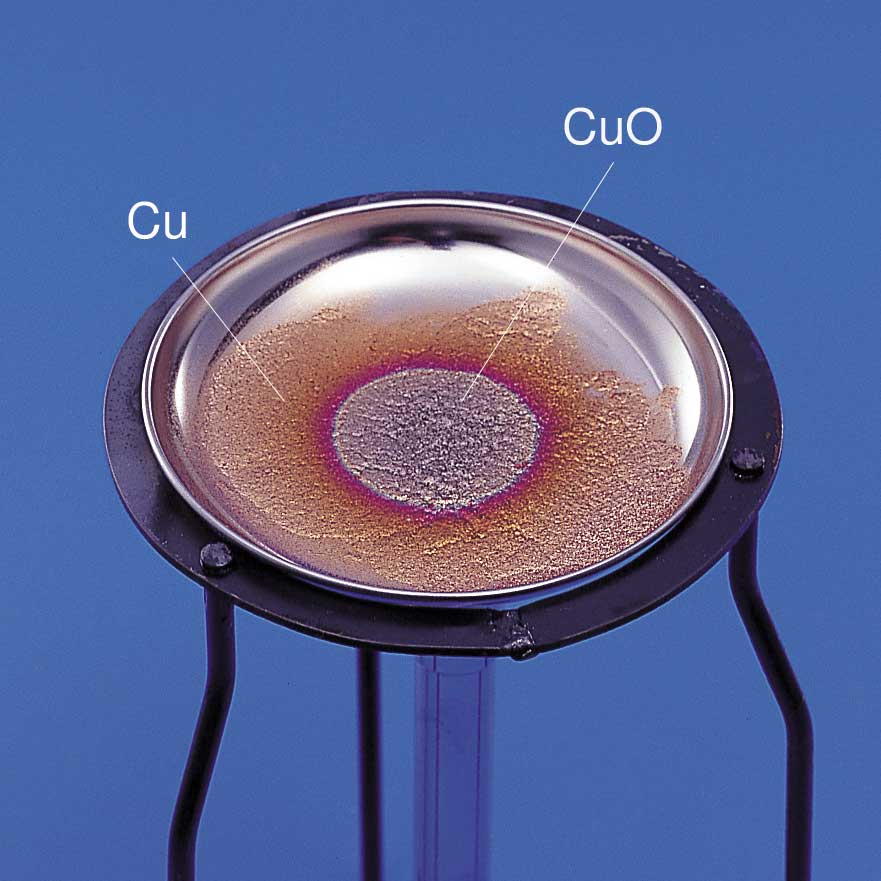
2.硫酸銅(II)五水和物と硫酸銅(II)の色の違いを答えなさい。 3.銅(II)イオンに塩基を反応させると,何の沈殿ができますか。 4.3の沈殿を加熱すると,何になりますか? 5.3の沈殿にアンモニア水を加えると,何イオンになりますか? アンモニアは、硝酸、アンモニウム塩、アミンの製造に重要な原料です。 アンモニアは室温で気体であり、加圧下で液化できます。 ステンレス鋼、アルミニウム、マグネシウム、チタンなどのほとんどの金属は、銅や他の銅合金を除いて、アンモニアガス、液体アンモニア、アンモニア水に対して優れた耐食性を備えています。 銅–ネイビーブラスとアルミニウム硫酸銅 (Ⅱ)を水に溶かすと青色の水溶液になる。 この水溶液にアンモニア水を過剰に加えると,水溶液は深青色を示す。 これは, ① テトラアンミン銅 (Ⅱ)イオン を生じるためである。 さらに塩酸を少量ずつ滴下すると ② 青白色の沈殿 が生じる。 硫酸銅 (Ⅱ)をつくるには, ③ 空気中で銅を酸化 し, ④ 表面に生じた黒色物質を希硫酸と反応させればよい




03 号 四塩化炭素含有アンモニア水を用いた銅抽出法 Astamuse




理科とか苦手で 硫酸銅
目的 硫酸銅溶液にアンモニアを加えてアンミン銅錯イオンの青色を 発色させ、分光光度計を用いて吸光度と銅濃度との関係曲線 (検量線)を作成する。 さらに、黄銅の一定量をとり、同様な条件で発色させ、その 吸光度から、検量線を用いて黄銅中の銅の量を定量する。 実験 操作Ⅰ硫酸銅+アンモニア&水酸化ナトリウム "CuSO4aq""NH3aq or NaOHaq"で青白色沈殿が生じ,青白色沈殿の原因は"Cu2""2OH"→"Cu (OH)2"↓で生じる"Cu (OH)2"だと習ったのですが、そうすると生成する沈殿は同じものと思うのですが、同じmol比で実験しても、資料集を見てもアンモニア水を入れたときは少し緑がかり、水酸化ナトリウムを入れたときよりもかなり白っぽいのですが、この ①試験管に硫酸銅水溶液を2mしとりアンモニア水を1,2滴加える ②①の沈殿物が溶けるまでアンモニア水を加える ③別の試験管に硫酸銅水溶液を2mしとり,硝酸バリウムを1,2滴加える



キリヤ Q A




銅イオン 水酸化銅 テトラアンミン銅 イオン Youtube
目的 硫酸銅溶液にアンモニアを加えてアンミン銅錯イオンの青色を 発色させ、分光光度計を用いて吸光度と銅濃度との関係曲線 (検量線)を作成する。 さらに、黄銅の一定量をとり、同様な条件で発色させ、その 吸光度から、検量線を用いて黄銅中の銅の量を定量する。 実験 操作Ⅰ アンミン銅錯イオンの吸収スペクトルの測定 方法 ①濃度の分かっている硫酸銅アンモニア 亜硫酸ガス 硫黄 塩化アルミニウム 塩化第二鉄 塩酸 塩水 過酸化ナトリウム 苛性ソーダ(温水) 酢酸 次亜塩素酸ナトリウム シアン化水素水 硝酸 乳酸 水(沸点) 硫酸 (青銅)銅を主成分として錫を含む合金 亜硫酸ナトリウム アンモニア 硫黄 過酸化水素 苛性ソーダ(温水濃アンモニア水 9 ml をビーカーにとり、これに硫酸銅五水和物 10 g を(細かい粉末 にして)少しずつ加えて溶かす。 (ガラス棒で)次に、この混合物に水酸化ナトリウム水溶液(2 mol/L)4 ml を少しずつ加えて、静かにかき混ぜると深青色の溶液ができる。これがシュバイツアー試薬である




が正しいのですが 硫酸はアンモニアよりも強い酸だから銅はアンモニアと反応できないの Clear



冶金の曙 実験編
化学 硫酸銅。 硫酸銅(?)水溶液にアンモニア水を3~4滴加えたら、どんな化学変化がおこるのか?それと、化学反応式がわかりません。教えて下さい。 質問No 『硫酸銅水溶液にアンモニア水を加えた』←反応式で表してください。 お願いします。 お願いします。 CuSO4 4NH3 → Cu(NH3)42 SO42 見にくいかもしれませんが、「SO42」は硫酸イオンで、「2」は上付き文字です。硫酸水素ナトリウム アンモニア(乾燥) 硝酸銅 炭酸ソ−ダ 塩化アンモニウム × × 硫酸銅 食塩 × × 水酸化アンモニウム 塩化第2鉄 × × カセイソ−ダ 硫酸アンモニウム 塩化第1鉄 × × 硝酸ナトリウム 炭酸バリウム 硫酸第2鉄 ケイ酸ソ−ダ 塩化バリウム × × 硫酸第1鉄 硫酸ソ−ダ 水酸化



無機化学 錯イオン生成反応




アクセス化学 例題解説 基本例題90 銅イオンの反応
アンモニア水では初め塩基性硫酸銅の青緑色沈殿を生じるが、過剰のアンモニアで、濃青色のアンミン錯塩を生ずる。 CuSO 4 ・Cu (OH) 2 +8NH 3 ―→ Cu (NH 3) 4 SO 4 + Cu (NH 3) 4 (OH) 2Fig 1の 酸化水銀および硫酸銅触媒を使用した実験結果では 15でもアンモニアの損失は認められない。このように本報と Bradstreet の結果の相異は, おそらく分解時の加熱条件の差に よるものと推定される。たとえば, 同一触媒比でも分解フラスコ の首部で硫酸蒸気を還流させた易合と, 首部の 先日、高校のテキストを読み返していたら銅イオンの反応ところの補足事項に目が留まりました。銅イオンを含む水溶液に塩基を加えるとCu^2 + 2OH^→ Cu(OH)2となることは理解しているのですが、この塩基がアンモニア水である場合では反




銅アンモニアレーヨン Wikipedia



硫酸銅とアンモニアと水から水酸化銅と硫酸アンモニウムができる反 Yahoo 知恵袋
硫酸銅水溶液+アンモニア水→水酸化銅+硫酸アンモニウム水溶液ということになるのですか? また、さらにアンモニア水を加えると銅アンモニアイオンが発生し、沈殿物は溶けますが cu(oh) 2 4nh 3 → cu(nh 3) 4 2 2oh (参考書より) なぜアンモニア水を加えているのに4nh 3 >となるので




1 Lihat Cara Penyelesaian Di Qanda




高校化学 無機物質 テスト8 第1問 問題編 映像授業のtry It トライイット




高校化学 アンモニアと沈殿 映像授業のtry It トライイット



アンモニアの噴水 実験 硫酸銅 無機化学 高校化学 エンジョイケミストリープラス Youtube




アクセス化学 例題解説 基本例題90 銅イオンの反応




理科とか苦手で 硫酸銅




高校化学 アルデヒドの性質 映像授業のtry It トライイット




高1化学 Clear




高校化学 無機物質 テスト8 第1問 問題編 映像授業のtry It トライイット



第19回おうちラボで実験してみた 遷移金属錯体テトラアンミン銅 硫酸塩を合成してみた みくあす令和ラボ




銅アンモニアレーヨンの合成 予備実験 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ




Periodic Table Cu



キリヤ Q A



第19回おうちラボで実験してみた 遷移金属錯体テトラアンミン銅 硫酸塩を合成してみた みくあす令和ラボ



化学画像bot 13chem Twitter



高校無機化学 銅 銀 金 11族 とその化合物の製法と性質まとめ 受験の月




理科とか苦手で 硫酸銅



化学



アクセス化学 例題解説 基本例題90 銅イオンの反応



化学反応式硫酸銅水溶液にアンモニア水を数滴垂らした時 沈殿が溶けるま Yahoo 知恵袋



キリヤ Q A



銅アンモニアレーヨンの合成




楽天市場 硫酸銅 Ii アンモニアの通販
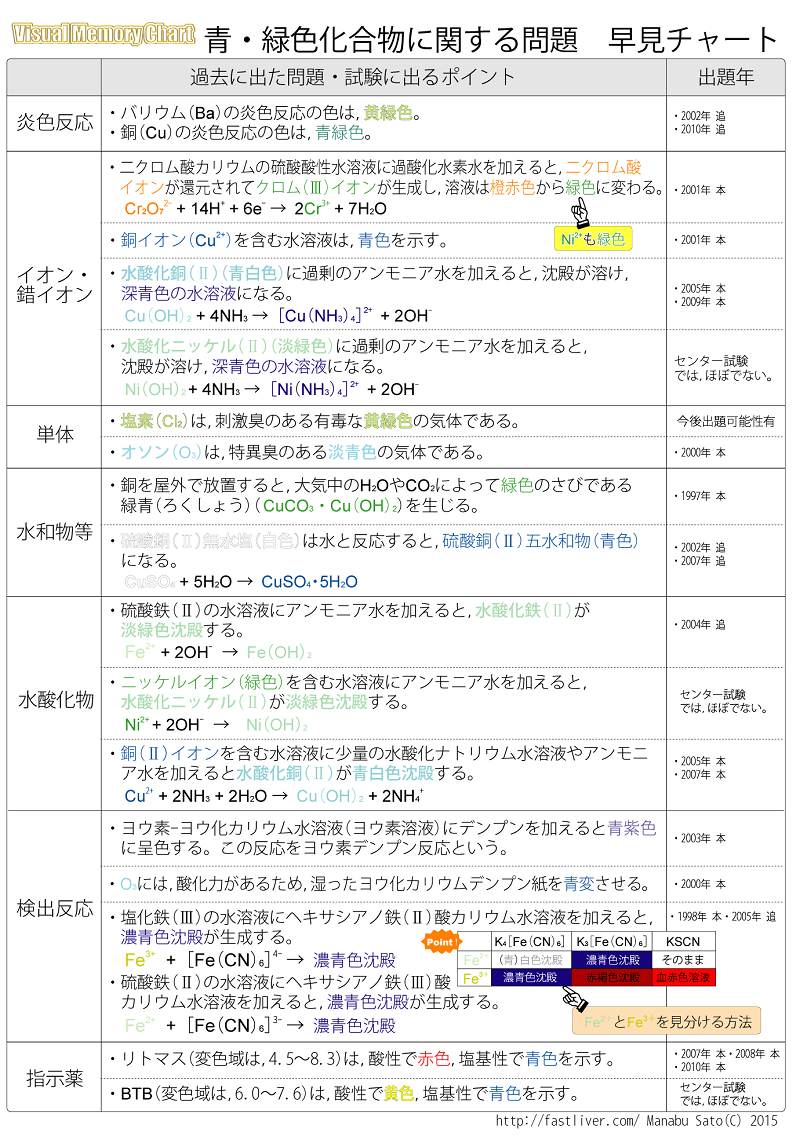



センター試験対策24 化学 青 緑色に関する問題 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc




A11銅イオンとアンモニア Cu2 Nh3 Mts Youtube



反応熱と熱化学方程式




硫酸銅加水 図解 水和 水和物とは 原理や仕組みなどを例を用 Chris Miller




銅を使った吸光度の実験をしたのですが 4 のモル吸光係数の求め方がわからないです Clear




高校化学 銅アンモニアレーヨン 映像授業のtry It トライイット



硫酸銅 Ii You Iggy




実験化学 60



硫酸銅水溶液の化学式は写真の化学式であっていますか い Yahoo 知恵袋



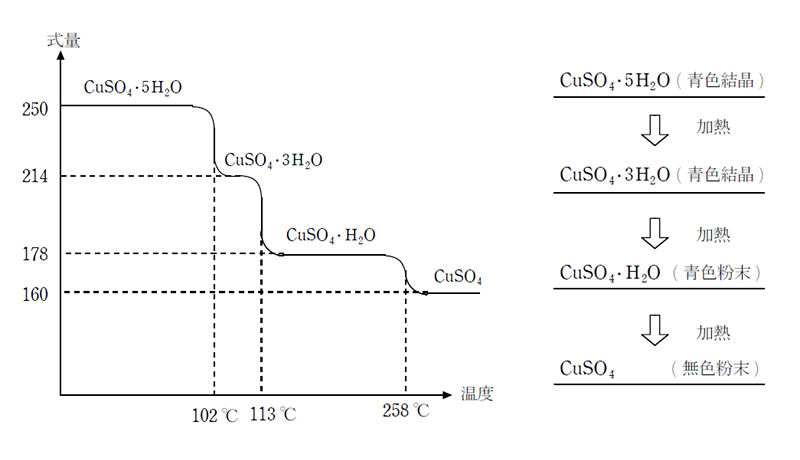
硫酸銅五水和物を加熱した場合の反応式はどうなりますか 無水硫酸銅 Yahoo 知恵袋




ろ液1には K Ca2 Zn2 Fe2 が残っています 濃硫酸加えて アンモニ 化学 教えて Goo



キリヤ Q A



アクセス化学 例題解説 基本例題90 銅イオンの反応



キリヤ Q A




Periodic Table Cu




13 号 銅化合物の溶解方法及び水処理方法並びに水処理剤 Astamuse




銅アンモニアレーヨンの合成
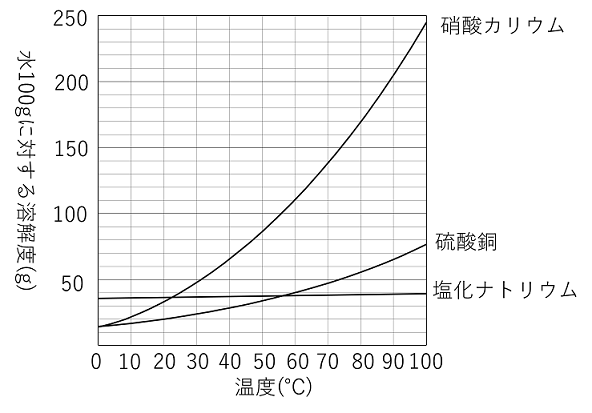



溶解と溶液




が正しいのですが 硫酸はアンモニアよりも強い酸だから銅はアンモニアと反応できないの Clear




理科とか苦手で 硫酸銅




Qktlbpzr Cue4m




銅アンモニアレーヨンの合成



7758 99 8 硫酸銅 Ii 五水和物 Copper Ii Sulfate Pentahydrate 039 039 031 033 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




銅と銅イオンの性質と化合物まとめ 沈殿の色など Irohabook




D Icui Descubre Como Resolverlo En Qanda



硫酸銅 液体 アンモニア 銅 反応 青色 の画像素材 写真素材ならイメージナビ



銅アンモニアレーヨンの合成



水酸化ナトリウム 硫酸銅 Corvet Photo Agency



 ①水酸化銅(Ⅱ) [青白色沈殿] 銅(Ⅱ)イオン水溶液にNaOH or 少量アンモニア ②テトラアンミン銅(Ⅱ)イオン [深青色] 水酸化銅(Ⅱ)に過剰アンモニア ③テトラクロリド銅(Ⅱ)酸イオン [黄緑色] 銅(Ⅱ)イオン水溶液に濃塩酸 ④硫酸銅 [黒色 ...')"/>
①水酸化銅(Ⅱ) [青白色沈殿] 銅(Ⅱ)イオン水溶液にNaOH or 少量アンモニア ②テトラアンミン銅(Ⅱ)イオン [深青色] 水酸化銅(Ⅱ)に過剰アンモニア ③テトラクロリド銅(Ⅱ)酸イオン [黄緑色] 銅(Ⅱ)イオン水溶液に濃塩酸 ④硫酸銅 [黒色 ...')"/>高校化学 水酸化物 水酸化銅 青白色沈殿 銅 イオン水溶液にnaoh Or 少量アンモニア テトラアンミン銅 イオン 深青色 水酸化銅 に過剰アンモニア テトラクロリド銅 酸イオン 黄緑色 銅 イオン水溶液に濃塩酸 硫酸銅 黒色




硫酸銅が溶ける様子と粒子の運動 State That Copper Sulfate Melts Youtube



キリヤ Q A




アクセス化学 例題解説 基本例題90 銅イオンの反応




理科とか苦手で 硫酸銅



水酸化ナトリウム 硫酸銅 Corvet Photo Agency




硝酸 アルミニウム 組成 式 硝酸アルミニウムとアンモニア水との反応



冶金の曙 実験編


 ①水酸化銅(Ⅱ) [青白色沈殿] 銅(Ⅱ)イオン水溶液にNaOH or 少量アンモニア ②テトラアンミン銅(Ⅱ)イオン [深青色] 水酸化銅(Ⅱ)に過剰アンモニア ③テトラクロリド銅(Ⅱ)酸イオン [黄緑色] 銅(Ⅱ)イオン水溶液に濃塩酸 ④硫酸銅 [黒色 ...')"/>
①水酸化銅(Ⅱ) [青白色沈殿] 銅(Ⅱ)イオン水溶液にNaOH or 少量アンモニア ②テトラアンミン銅(Ⅱ)イオン [深青色] 水酸化銅(Ⅱ)に過剰アンモニア ③テトラクロリド銅(Ⅱ)酸イオン [黄緑色] 銅(Ⅱ)イオン水溶液に濃塩酸 ④硫酸銅 [黒色 ...')"/>高校化学 水酸化物 水酸化銅 青白色沈殿 銅 イオン水溶液にnaoh Or 少量アンモニア テトラアンミン銅 イオン 深青色 水酸化銅 に過剰アンモニア テトラクロリド銅 酸イオン 黄緑色 銅 イオン水溶液に濃塩酸 硫酸銅 黒色




理科とか苦手で アルミ箔で銅の廃液処理 後編




アンモニア Nh3 の電離式を教えてください Clear




銅アンモニアレーヨンの合成




硫酸銅加水 図解 水和 水和物とは 原理や仕組みなどを例を用 Chris Miller




佐藤奥様 硫酸銅 モノタロウでも売ってました うわぁ



第130章 実験 ナイロンとレーヨン




理科とか苦手で 硫酸銅




レーヨン 銅アンモニアレーヨン を作ってみました Youtube



銅アンモニアレーヨンの合成




12 Ca Lihat Cara Penyelesaian Di Qanda




銅アンモニアレーヨンの合成 予備実験 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ



無機化学 第12回 遷移元素 Cu Ag 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム



レーヨン 1




語呂合わせ 銅イオンの反応と色の覚え方 語呂合わせ 銅と塩基の反応による水酸化銅の沈殿 過剰なアンモニアでの錯イオンの色と形 酸化銅 硫酸銅の色と特徴 緑青 無機化学 ゴロ化学 Youtube




硫酸銅法の意味 用法を知る Astamuse



化学実験 Ii属 銅




7758 98 7 硫酸銅 Ii Copper Ii Sulfate 030 034 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬



硫酸銅水溶液2molに1mol Lのアンモニア水を少しずつ 2 3 Yahoo 知恵袋



第6回おうちラボで実験してみた セルロース再生繊維のキュプラを合成してみた みくあす令和ラボ



中3化学 アンモニアの利用 中学理科 ポイントまとめと整理




劇物 危険物 硫酸銅 化学薬品 工業薬品 食品添加物 食品 試験薬品 試薬 の販売 製造 Oemの内藤商店 愛知県 名古屋市



硫酸銅 五水和物の水溶液にアンモニア水を加えていくと 青白色の沈 Yahoo 知恵袋




イオン化傾向は銅の方が低いと思うのですが 操作ア で硫酸銅ができないのはなぜですか Clear




銅アンモニアレーヨンの合成 予備実験 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ


0 件のコメント:
コメントを投稿